25.05.2018
Я.Б. Миркин, А.В. Карапетян, С.Ю. Шумов ММЦ «УРО-ПРО», г. Краснодар
Сведения об авторах:
Миркин Я.Б. – заведующий отделением урогинекологии и нейроурологии ММЦ «УРО-ПРО», г. Краснодар, mirkom@yandex.ru
Mirkin Ya.B. – the head of the department of urogynecology and neurourology MMC "URO-PRO", Krasnodar, mirkom@yandex.ru
Карапетян А.В. – генеральный директор ММЦ «УРО-ПРО», г. Краснодар, krasnodar1@upclinic.ru
Karapetyan A.V. – General Director of the MMC "URO-PRO", Krasnodar, krasnodar1@upclinic.ru
Шумов С.Ю. – директор МЦ «УРО-ПРО», г. Краснодар, krasnodar1@upclinic.ru
Shumov S.Yu. – Director of the MMC «URO-PRO», Krasnodar, krasnodar1@upclinic.ru
Интерстициальный цистит (ИЦ) или, согласно определениям ICS и ESSIC, – синдром болезненного мочевого пузыря (СБМП) – заболевание, которое крайне редко приводит к смертельному исходу (в основном, вследствие осложнений), однако его влияние на качество жизни трудно переоценить – оно служит причиной резкого снижения социальной адаптации и фактически инвалидности.
У 11% пациентов с ИЦ имеются суицидальные тенденции [1].Ранее считалось, что ИЦ/СБМП является достаточно редким заболеванием, однако в последние годы количество пациентов с симптомами ИЦ драматически увеличилось.
Исследование эпидемиологии ИЦ в США, выполненное J. Clemens и соавт. демонстрирует цифру 197 пациентов на 100 000 женщин [2]. C.A. Jones в 1997 опубликовал данные опроса женщин в США, согласно которым распространенность ИЦ в этой стране составляет 510/100 000 женщин [3].
Разумеется, невозможно поставить диагноз ИЦ всему количеству указанных пациентов, поскольку для этого требуется правильно выполненная цистоскопия и качественное патоморфологическое исследование биоптата, но диагноз «Синдром болезненного мочевого пузыря» будет вполне правомерен [4].
Продолжительное время ИЦ считался диагнозом исключения, т.е. для постановки диагноза требовалось исключить все возможные заболевания со схожей симптоматикой, и при их отсутствии установить диагноз ИЦ. Затем группа экспертов из ESSIC разработала диагностические критерии ИЦ, которые включали в себя наличие гломеруляций при цистоскопии с гидробужированием мочевого пузыря и/или Гуннеровского поражения, а также повышенного числа тучных клеток и/или подслизистого фиброза при патоморфологическом исследовании [4].
В дальнейшем было принято решение ввести термин «Синдром болезненного мочевого пузыря», диагностика которого основывалась на соответствующих симптомах – боль над лоном, связанная с наполнением мочевого пузыря, поллакиурия и ноктурия при отсутствии явной урологической патологии [5]. Отличие СБМП от ИЦ заключается в том, что диагноз СБМП может быть поставлен при отсутствие цистоскопических и морфологических исследований, на основании присущего ИЦ симптомокомплекса [6].
В настоящее время применимы оба термина – ИЦ и СБМП – однако диагноз ИЦ требует более строгих критериев. ИЦ/СБМП Патогенез ИЦ/СБМП все еще не вполне ясен, однако концепция, согласно которой вся цепь событий, приводящих к возникновению ИЦ, происходит только в уротелии, безвозвратно канула в прошлое. ИЦ/СБМП в большинстве случаев является полиорганным заболеванием, в патогенез которого вовлечены мочевой пузырь, органы малого таза, мышцы тазового дна и промежности, центральная нервная система (ЦНС). Процессы, протекающие в уротелии, играют значительную роль в патогенезе ИЦ. Представление о том, что уротелий является просто барьером между мочой и более глубокими слоями стенки мочевого пузыря, потеряло актуальность.
На данный момент известно, что уротелий представляет собой специализированную ткань, которая комплексно регулирует функции мочевого пузыря, обладает секреторной и рецепторной функциями и играет фундаментальную и активную роль в патогенезе различных форм цистита и симптомов нижних мочевых путей [7]. Тем не менее, барьерная функция уротелия является самой важной из всех. С анатомической точки зрения, мочевой пузырь представляет собой полый сферический орган, стенка которого состоит (снаружи кнутри) из серозного, мышечного, подслизстого, слизистого слоев и собственной пластинки. В эту структуру встроены кровеносные сосуды, нервные окончания (сенсорные и моторные), компоненты иммунной системы.
Слой эпителиальных клеток (уротелий) расположен поверх собственной пластинки и покрывает внутреннюю поверхность мочевого пузыря. В свою очередь, уротелий покрыт гликозаминогликановым слоем, позволяющим минимизировать повреждение мочевого пузыря вследствие воздействия компонентов мочи. Для выполнения этой функции, уротелий должен обладать следующими свойствами:
- накопление мочи: мочевой пузырь должен иметь возможность накопления и удержания различных объемов мочи, поддерживая при этом минимальное соотношение площади уротелия к объему мочи. Именно поэтому, наполненный мочевой пузырь представляет собой идеальную в геометрическом плане фигуру – сферу. Сфера обладает минимальной поверхностью, таким образом минимизируя возможность диффузии токсичных компонентов мочи в кровяное русло;
- пассивная проницаемость: за исключением активно транспортируемых молекул, уротелий должен быть непроницаем для всех, находящихся в моче веществ. Перемещение через эпителий происходит двумя параллельными путями – трансцеллюлярным и через межклеточное пространство (парацеллюлярный путь). Следовательно, клеточная мембрана и плотные контакты уротелия должны быть непроницаемы для всех компонентов мочи. Изменение свойств клеточной мембраны и/или плотных контактов может привести к изменению барьерной функции уротелия;
- активный транспорт: мочевой пузырь должен иметь возможность регулировать активный транспорт между полостью мочевого пузыря и кровотоком, а также в обратном направлении;
- инертность: вещества, в норме присутствующие в моче или крови не должны изменять пассивную проницаемость апикальной мембраны или плотных контактов.
Перед тем, как рассмотреть уротелий в свете вышеуказанных свойств, будет полезно описать структуру уротелия. Он представляет собой переходный эпителий, который полностью возобновляется примерно за 3-6 месяцев, что было продемонстрировано в эксперименте на морских свинках. Интересен тот факт, что это самая низкая скорость возобновления среди всех эпителиальных тканей млекопитающих. В поперечном сечении уротелий состоит из трех слоев, причем у каждого есть свои особенности (рис.1).
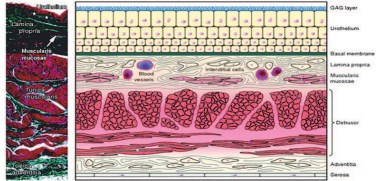
Рис. 1. Поперечное сечение уротелия.
Базальный слой состоит из клеток диаметром 5-10 мкм, промежуточный слой – 20 мкм и поверхностный слой, представленный зонтичными клетками, размер которых колеблется, в зависимости от степени растяжения 50-120 мкм. Зонтичные клетки связаны между собой т.н. плотными сочленениями. Поверхность зонтичных клеток покрыта толстым слоем гликопротеи- нов и протеогликанов, вместе формирующих гликозаминогликановый слой (ГАГ), который входит в состав гидрофильной слизистой оболочки и является барьером против токсичных субстанций мочи.
Гликозаминогликаны также присутствуют в синовиальной жидкости сустава (гиалуроновая кислота) и в соединительной ткани (хондроитин). Между зонтичными клетками и гликозаминогликановым слоем расположен слой полигональных образований, выполненных из уроплакина [8]. Роль ГАГ-слоя активно изучается, так как экспериментальные данные показали, что его дефект может стать первым шагом к развитию хронического воспалительного процесса в мочевом пузыре [9].
Несмотря на наличие определенных данных, этиология хронического цистита по-прежнему остается неясной. Повреждение уротелия на данный момент считается основной причиной возникновения приведенных нами патологий мочевого пузыря. Но что именно приводит к повреждению эпителия? Рассматривать в качестве фактора риска нужно не только бактериальную инфекцию, но и нейрогенное воспаление, дисфункцию тазового дна, лекарственные препараты (химиотерапия) и лучевую терапию. Также не стоит забывать и об аутоиммунном ответе, а при расспросе больного уточнить сведения о наличии травмы мочевого пузыря. Повреждение уротелия может иметь нейрогенную природу, что было продемонстрировано в эксперименте на мышах – при пересечении спинного мозга у них наблюдалось быстрое развитие повреждения уротелия (рис. 2) [10].
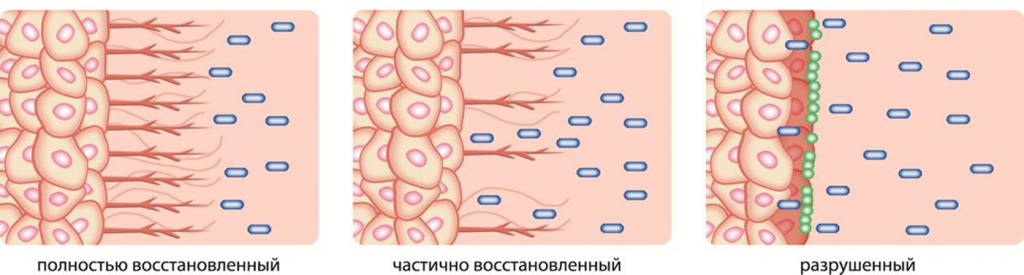
Рис. 2. Состояния глюкозамингликанового слоя мочевого пузыря.
При утечке компонентов мочи через травмированный уротелий в интерстиций стенки мочевого пузыря активируется каскад реакций, включающий в себя активацию С-волокон, тучных клеток и высвобождение гистамина и других нейропептидов. Независимо от причины повреждения начинается воспалительный процесс, развивающийся всегда по одной и той же схеме.
Уротелий утрачивает барьерную функцию защиты от субстанций, выделяющихся с мочой. Эти вещества вступают в контакт с субэпителиальными слоями, вызывая воспаление в субуротелии. Поскольку в этом слое расположены нервные сплетения, они вовлекаются в воспалительный процесс, что приводит к развитию соответствующей симптоматики: боли, поллакиурии, ургентным позывам и ноктурии.
Кроме того, при длительном воздействии, происходит сенсибилизация нервных окончаний, то есть снижается порог их реагирования на различную стимуляцию (рис. 3).
Предполагается, что из-за снижения продукции ГАГ уротелий становится более проницаемым, усугуб- ляется первичное повреждение. Именно на это звено патогенеза направлена терапия, оказывающая влияние на восстановление ГАГ-слоя. В ответ на усугубляющееся повреждение уротелий запускает процесс репарации путем секреции различных факторов роста, но неразрешенное, не до конца вылеченное воспаление блокирует эту реакцию путем секреции антипролифера- тивного фактора, который повышен у больных ИЦ. Кроме того, секреция простагландина Е2, способствующего восстановлению уротелия, существенно снижается или даже отсутствует у пациентов с интерстициальным циститом и синдромом болезненного мочевого пузыря. Значительную роль в развитии воспаления играют тучные клетки, которые экскретируют цитокины (ФНО, ИЛ-4, ИЛ-15, ИЛ-8, ИЛ-6), факторы роста (ФРН и пр.) [11,12].
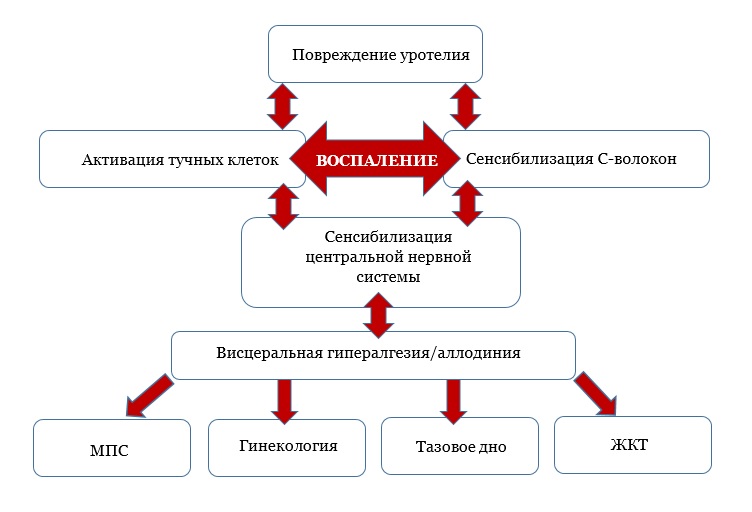
Рис 3. Предполагаемый патогенез интерстициального цистита.
СЕНСИБИЛИЗАЦИЯ ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ
Стоит обратить особое внимание на то, что в рецепторной активности периферических органов и нервной ткани происходят некоторые изменения, активирующие нейроны в центральной нервной системе (ЦНС), т.н. централизация боли, и при длительном течении процесса вероятность развития хронической нейропатической боли значительно возрастает. Такой ход событий вполне объясняет, почему несвоевременная терапия не работает и состояние переходит в хроническую форму, т. е. наступает момент, когда терапия, направленная на уротелий, перестает быть эффективной.
Повреждение уротелия вызывает активацию С-волокон, приводя к сокращению гладкой мускулатуры, нейрогенному воспалению и гиперчувствительности нервных окончаний. Клинически этот комплекс реакций проявляется частыми императивными позывами и хронической тазовой болью – отличительные особенности синдрома болезненного мочевого пузыря и/ или синдрома гиперактивного мочевого пузыря.
Нейрогенное воспаление – результат патологической активации первичных чувствительных нервов(С-волокон), которые подразделяются на афферентные и эфферентные. Афферентные волокна отвечают за передачу болевого сигнала, модуляцию кардиоваскулярного рефлекса и контролируют рефлекс мочеиспускания, в то время как эфферентные – напрямую связаны с высвобождением субстанции Р, кальцитонин ген связанного пептида и тахикининов, вызывающих характерное для синдрома гиперактивного мочевого пузыря сокращение гладких мышечных волокон.
Эфферентные волокна также отвечают за миграцию иммунных клеток, дегрануляцию тучных клеток и петехиальные кровоизлияния, способствующие усилению боли. Предполагают, что нейрогенное воспаление является источником той висцеральной гиперчувствительности, которая приводит к развитию хронической тазовой боли. Это позволяет сделать вывод о том, что чаще всего возникновение синдрома болезненного мочевого пузыря обусловлено не только воспалительным процессом, но и гиперчувствительностью, которая проявляется аллодинией (неадекватный болевой ответ на нормальную стимуляцию) и гипералгезией (аномальный увеличенный ответ на болевой стимул средней степени). В свою очередь, стимулированные периферические ноцицепторы посылают в ЦНС афферентную импульсацию приводя в действие центральные механизмы, которые усиливают и закрепляют эффект периферической сенсибилизации.
Функция афферентных нервных волокон реализуется через рецепторный аппарат уротелия. Роль различных типов нервных волокон и рецепторов представляется следующей: А-лямбда волокна ассоциированы с механорецепторами, при давлении вмочевом пузыре менее 5-15 мм рт. ст.они неактивны, т.е. позыв на мочеиспускание отсутствует, но при достижении определенного порога А-лямбдаволокна непрерывно генерируют импульсы, кодирующие ощущение давления в мочевом пузыре, они отвечают за ощущение позыва на мочеиспускание, однако при повышении давления более 30 мм рт.ст. они начинают генерировать импульсы, кодирующие ощущение боли [13].
Кроме того, А-лямбда волокна и ассоциированные рецепторы могут сенсибилизироваться и кодировать болевые импульсы. То есть в некоторых случаях, играть роль ноцицепторов.Лигандом этих пуринергических (P2X,P2Y) рецепторов является аденозин-трифосфат (АТФ). Чувство давления при наполнении мочевого пузыря прямо коррелирует с уровнем АТФ и наибольший уровень АТФ определяется в момент мочеиспускания. АТФ секретируется клетками уротелия, причем количество секретируемого АТФ зависит от степени растяжения уротелия – чем больше АТФ, тем сильнее позыв [14] (таб.1).
Таблица 1. Рецепторный аппарат уротелия
|
Сенсорная функция или лиганд |
Сенсорный рецептор в уротелии | Сенсорный рецептор в афферентном нерве |
| АТФ | Пуринергический рецептор P2X, P2Y | Пуринергический рецептор P2X, P2Y |
| Капсаицин | Ваниллоидный TRPV1 | Ваниллоидный TRPV1 |
| Тепло | TRPV1, TRPV2, TRPV4 | TRPV1,TRPV2,TRPV3,TRPV4 |
| Холод | TRPM8, TRPA1 | TRPM8, TRPA1 |
| pH | TRPV1 | TRPV1, ASIC, DRASIC |
| Осмолярность | TRPV4 | TRPV4 |
| Брадикинин | В1, В2 брадикининовые рецепторы | В1, В2 брадикининовые рецепторы |
| Ацетилхолин | Никотиновые и мускариновые рецепторы | Никотиновые и мускариновые рецепторы |
| Норадреналин | Альфаи бетаадренорецепторы | Альфаи бетаадренорецепторы |
| Фактор Роста Нервов | p-75, Trk-A | p-75, Trk-A |
| Механическая чувствительность | Амилорид-чувствительные натриевые каналы | Амилорид-чувствительные натриевые каналы |
С-волокна и ассоциированные с ними рецепторы (ванилоидные TRPV1, TRPV2, TRPV4) отвечают за температурную, химическую и болевую чувствительность, понижение рН мочи (TRPV1), повышение осмолярности мочи (TRPV4). При достижении критических параметров хеморецепторы могут генерировать болевые импульсы [16,17]. На этом осно ван тест с калия хлоридом, поскольку при ИЦ нарушается функция этих рецепторов и порог генерации болевых импульсов значительно снижается. А некоторые рецепторы извращают свою функцию, например, TRPM8 и TRPA1, отвечающие за холодовую чувствительность, при введении холодного раствора в мочевой пузырь они генерируют болевые импульсы и/или ургентные позывы на микцию. На этом основан соответствующий диагностический тест при уродинамическом исследовании [18].
ЭФФЕКТ CROSS-TALKING
Кроме мочевого пузыря, в малом тазу у женщин находится матка с придатками и нисходящие отделыкишечника. Афферентные и эфферентные нервные пути этих органов взаимосвязаны и патологический процесс в одном органе может отразиться на другом. Например, у 50% пациентов с ИЦ присутствует синдром раздраженного кишечника (СРК) и наоборот, пациенты с СРК часто страдают от синдрома болезненного мочевого пузыря.
Пациентки с аденомиозом демонстрируют поллакиурию и боль в области мочевого пузыря, у пациенток с ИЦ часто развивается вульводиния. Этот эффект называется «взаимонаведением» (в англоязычной литературе – cross-talking) и реализуется через феномен сенсибилизации ЦНС [19]. При хронической болевой афферентной импульсации от какого-либо из органов малого таза происходит сенсибилизация рецепторов в ЦНС [20].
Орган, генерирующий эти импульсы, считается первичным генератором боли [21], при ИЦ им является уротелий. Сенсибилизированные рецепторы, в свою очередь, генерируют эфферентные импульсы в уротелий, которые модулируют его рецепторный аппарат, вызывают нейрогенное воспаление, а поскольку афферентные и эфферентные пути органов малого таза тесно взаимосвязаны, нейрогенное воспаление и изменение функции рецепторного аппарата может произойти в соседнем органе малого таза, например, в кишечнике – с развитием СРК. В таком случае, кишечник называется вторичным генератором боли. Интересно то, что в некоторых случаях, патологический процесс в первичном генераторе боли давно купирован, а вторичный генератор продолжает портить жизнь пациенту и нервы врачам [22,23].
Мышцы тазового дна являются поперечно-полосатыми мышцами, и в ответ на болевую импульсацию от одного из органов малого таза может развиться рефлекторный спазм одной или нескольких мышц тазового дна.Например, при анальной трещине часто развивается спазм леваторов. При хроническом процессе спазм тоже становится хроническим. Это называется миофасциальным болевым синдромом (МФС). ИЦ может ассоциироваться с МФС леваторов, внутренней запирательной мышцы, наружного сфинктера уретры (синдром Фоулера), поверхностных мышц промежности.
В мышцах возникают триггерные точки, которые являются вторичными генераторами боли [24,25]. Сенсибилизация ЦНС реализуется через феномен нейропластичности, неразрывно связанный с НМДА-рецепторами – постоянное повторение одного и того же действия приводит к развитию привычки к этому действию, своего рода условному рефлексу, т.е.для выполнения нужного действия мозг расходует меньше ресурсов. Но когда речь идет о постоянной повторяющейся боли и выработке «привычки» к ней – нейропластичность начинает играть огромную роль в патогенезе синдрома хронической тазовой боли (СХТБ) вообще и ИЦ/СБМП в частности. Пациенту с централизацией боли можно вообще удалить пораженный орган – а боль останется, становясь проявлением разновидности фантомной боли [25,26].
ВЫВОДЫ
Подводя итоги обсуждения патогенеза интерстициального цистита/синдрома болезненного мочевого пузыря (ИЦ/СБМП), можно сделать вывод, что интерстициальный цистит начинается с повреждения гликозаминогликанового слоя уротелия и уже потом в процесс вовлекаются остальные звенья патогенеза (ЦНС, органы и мышцы малого таза). В этом случае, восстановление ГАГ-слоя уротелия становится первоочередной задачей. Что касается синдрома болезненного мочевого пузыря – в этом случае уротелий чаще всего является вторичным генератором боли, а первичным генератором может выступать другой орган малого таза или даже ЦНС, например, в случае хронического стресса. В таком случае, восстановление уротелия тоже необходимо, но при обязательных терапевтических мероприятиях, направленных на прекращение патологического процесса первичного генератора боли.
Резюме:
Интерстициальный цистит/Синдром болезненного мочевого пузыря является тяжелым заболеванием с выраженным влиянием на качество жизни. Существующие методы лечения не всегда эффективны, поскольку Интерстициальный цистит/Синдром болезненного мочевого пузыря имеет комплексный, мультифакторный патогенез. Современные представления о патогенезе интерстициального цистита складываются из взаимодействия таких факторов, как:
1. Повреждение уротелия с разрушением защитного гликозаминогликанового слоя.
2. Развитие абактериального воспаления в интерстиции с активизацией тучных клеток и миграцией их в очаг воспаления.
3. Сенсибилизация периферической нервной системы с увеличением количества ноцицепторов.
4. Взаимонаведение органов малого таза с развитием нейрогенного воспаления в кишечнике, матке, придатках.
5. Миофасциальные болевые синдромы тазового дна с развитием спастичности поперечнополосатой мускулатуры тазового дна и промежности.
6. Централизация боли (сенсибилизация ЦНС) с понижением болевого порога и возникновением стойкого болевого синдрома даже после прекращения поступления болевых импульсов от пораженного органа. Вследствие этого, успешная терапевтическая стратегия должна включать в себя воздействие на все факторы патогенеза интерстициального цистита. Авторы заявляют об отсутствии конфликта интересов.
 Версия для слабовидящих
Версия для слабовидящих


